zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
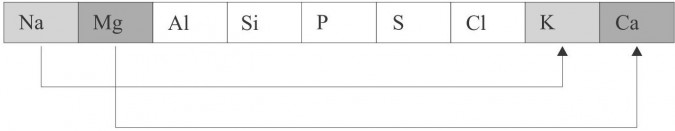
PRAWO TRIAD - J. Döbereiner zauważył, że dla wybranych trójek pierwiastków masa atomowa pierwiastka środkowego jest równa w przybliżeniu średniej arytmetycznej mas atomowych pierwiastków skrajnych, np. w przypadku trójki: Li, Na, K masa atomowa pierwiastka środkowego, tj. Na (23u) powinna być równa średniej arytmetycznej mas atomowych Li (7u) i K (39u). Wykonajmy obliczenia:
OKTAWY NEWLANDSA - Newlands zauważył, że jeśli ułożymy pierwiastki wg wzrastającej masy atomowej, stwierdzimy, że co ósmy z nich ma podobne właściwości:
UKŁAD OKRESOWY PIERWIASTKÓW MENDELEJEWA 1869 r.
Mendelejew ułożył pierwiastki wg wzrastającej masy atomowej i w oparciu o sformułowane przez siebie prawo okresowości.
Prawo okresowości - właściwości chemiczne i fizyczne pierwiastków uporządkowanych wg wzrastającej masy atomowej zmieniają się okresowo.
Prawu temu Mendelejew przyznał pierwszeństwo przy klasyfikacji pierwiastków przestawiając kolejność niektórych z nich w Układzie Okresowym, np:
para jod - tellur: mI = 126,9u < mTe = 127,6u, a więc jod (I) powinien się znaleźć w Układzie Okresowym przed tellurem (Te), jednak Mendelejew uznał, że prawo okresowości czyli powtarzającego się okresowo podobieństwa właściwości fizycznych i chemicznych jest tu ważniejsze i przestawił kolejność pierwiastków. Tak więc tellur znalazł się w tej samej grupie, co mająca podobne właściwości siarka, a jod w grupie pierwiastków o podobnych do niego właściwościach, np. Br.
Dla nieznanych wówczas pierwiastków Mendelejew zostawił wolne miejsca w Układzie Okresowym.
WSPÓŁCZESNY UKŁAD OKRESOWY PIERWIASTKÓW - pierwiastki uporządkowane są według rosnącej liczby atomowej (Z), a ich właściwości zmieniają się okresowo.
Współczesny Układ Okresowy podzielony jest na 18 grup (kolumn pionowych) i 7 okresów (rzędów poziomych).
W grupach znajdują się pierwiastki o podobnych właściwościach wynikających z tej samej liczby elektronów walencyjnych (ich ilość jest zgodna z numerem grupy, a dla grup 13-18 jest równa cyfrze jedności w numerze grupy). Nazwy grup wywodzą się od nazwy pierwszego pierwiastka w grupie, np. grupa 13 - borowce, grupa 16 - tlenowce itp.
Na podstawie numeru grupy możemy podać wartościowość pierwiastka względem tlenu i wodoru.
Maksymalna wartościowość pierwiastka względem tlenu jest równa cyfrze jedności w numerze grupy, np.:
K - gr. I, wartościowość I, wzór połączenia Na2O
S - gr. 16, wartościowość VI, wzór połączenia SO3
Wartościowość pierwiastka względem wodoru jest zgodna z cyfrą jedności w numerze grupy dla grup 1-14, od grupy 15 stanowi uzupełnienie do 18, np.:
Al - gr. 13, wartościowość III, wzór połączenia AlH3
P - gr. 15, wartościowość III (18-15), wzór połączenia PH3
W przypadku wodorków z grupy 16 i 17 piszemy najpierw symbol wodoru, a potem niemetalu.
W okresach znajdują się pierwiastki o takiej samej liczbie powłok elektronowych (ilość powłok = numer okresu), których właściwości zmieniają się stopniowo od aktywnych metali do aktywnych niemetali, każdy okres zamyka gaz szlachetny.
Istnieje więc ścisła zależność pomiędzy budową atomu a jego położeniem w Układzie Okresowym.
Związek miedzy budową atomu a położeniem pierwiastka w Układzie Okresowym
Uzupełnij tabelkę:
| Symbol pierwiastka | Numer okresu | Numer grupy | Liczba elektronów | Liczba elektronów walencyjnych | Liczba powłok | Konfiguracja elektronowa |
|---|---|---|---|---|---|---|
| 20Ca | ||||||
| 3 | 15 | |||||
| 9 | ||||||
| K2L8M18N18O4 |
Odpowiedź:
| Symbol pierwiastka | Numer okresu | Numer grupy | Liczba elektronów | Liczba elektronów walencyjnych | Liczba powłok | Konfiguracja elektronowa |
|---|---|---|---|---|---|---|
| 20Ca | 4 | 2 | 20 | 2 | 4 | K2L8M8N2 |
| 15P | 3 | 15 | 15 | 5 | 3 | K2L8M5 |
| 9F | 2 | 17 | 9 | 7 | 2 | K2L7 |
| 50Sn | 5 | 14 | 50 | 4 | 5 | K2L8M18N18O4 |
Omówienie:
a) znając symbol pierwiastka sprawdzamy, w którym okresie (rzędy poziome) leży i wpisujemy do tabelki nr okresu (dla wapnia - 4), ponieważ jest on równy liczbie powłok w atomie, wpisujemy do tabelki - 4. Wapń znajduje się w grupie 2 czyli ma 2, elektrony walencyjne. Liczba atomowa wapnia wynosi 20 (lewy dolny róg symbolu), a więc wszystkich elektronów jest 20. Pozostaje do napisania konfiguracja; wypisujemy kolejno 4 powłoki (K L M N), na ostatniej wpisujemy liczbę elektronów walencyjnych, która jest równa numerowi grupy, a dla pozostałych liczbę elektronów obliczamy zgodnie z poznanymi zasadami.
b) Znając numer okresu i numer grupy szukamy w Układzie Okresowym pierwiastka, który leży w grupie 15 (ma 5 elektronów walencyjnych, dla grup 13-18 jest ona równa cyfrze jedności w numerze grupy) i jednocześnie w 3 okresie (ma 3 powłoki), jest to fosfor. Odczytujemy jego liczbę atomową (Z = 15), która jest równocześnie liczbą elektronów w atomie (15) i zapisujemy konfigurację rozmieszczając 15 elektronów na 3 powłokach zgodnie z poznanymi wcześniej regułami.
c) Liczba wszystkich elektronów w atomie (9) jest równa liczbie atomowej (Z = 9) fluoru. Szukamy, w której grupie on leży (17), a więc ma 7 elektronów walencyjnych (17-10). Znajduje się w 2 okresie, czyli ma 2 powłoki (K L), na których rozmieszczamy 9 elektronów.
d) sumując liczbę elektronów na poszczególnych powłokach, dostajemy ilość elektronów w atomie, która jest równocześnie liczbą atomową (Z = 50) cyny. Leży ona w 14 grupie (4 elektrony walencyjne) i w 5 okresie (5 powłok, co można było odczytać także na podstawie konfiguracji).
Uzupełnij tabelkę:
| Numer grupy | ||||||
| Symbol pierwiastka | Na | Ca | Si | N | Se | Cl |
| Maksymalna wartościowość względem tlenu | ||||||
| Wzór tlenku | ||||||
| Wartościowość względem wodoru | ||||||
| Wzór wodorku |
Odpowiedź:
| Numer grupy | 1 | 2 | 14 | 15 | 16 | 17 |
| Symbol pierwiastka | Na | Ca | Si | N | Se | Cl |
| Maksymalna wartościowość względem tlenu | I | II | IV | V | VI | VII |
| Wzór tlenku | Na2O | CaO | SiO2 | N2O5 | SeO3 | Cl2O7 |
| Wartościowość względem wodoru | I | II | IV | III | II | I |
| Wzór wodorku | NaH | CaH2 | SiH4 | NH3 | H2Se | HCl |
Omówienie:
Maksymalną wartościowość pierwiastków względem tlenu odczytujemy z cyfry jedności w numerze grupy i na jej podstawie uzgadniamy wzory tlenków (wartościowość wpisujemy na krzyż, pamiętając że tlen jest II-wartościowy).
Dla grup 1-14 wartościowość względem wodoru jest równa cyfrze jedności, natomiast dla grup 15-17 stanowi uzupełnienie do 18 (mając pierwiastek np. z grupy 17, odejmujemy od 18 liczbę 17 i dostajemy wartościowość I). Uzgadniamy wzór pamiętając, że wodór jest I-wartościowy oraz że dla pierwiastków z grupy 16 i 17 piszemy symbole w odwrotnej kolejności, tj. najpierw wodoru, potem niemetalu.
Uszeregować od najmniej do najbardziej aktywnego następujące metale: arsen, wapń, potas, gal, german.
Odpowiedź:
Pogłębiaj wiedzę w temacie: Próby usystematyzowania pierwiastków
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.