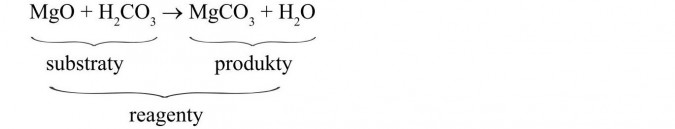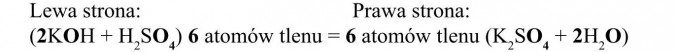zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
1. Zjawisko fizyczne (przemiana fizyczna) - przemiana, w czasie której nie ulega zmianie rodzaj substancji, następuje jedynie zmiana właściwości fizycznych takich jak stan skupienia, gęstość, stan rozdrobnienia.
Przykłady:
- topnienie lodu; podczas ogrzewania następuje zmiana stanu skupienia z ciała stałego w ciecz (jest to cały czas ten sam związek chemiczny - H2O).
- topnienie świecy; podczas ogrzewania świeca topi się, a spływające krople stearyny ponownie ulegają zestaleniu. Topnienie i krzepnięcie (przejście z cieczy w ciało stałe) to zjawiska fizyczne.
- cięcie kartki papieru; przemiana fizyczna polegająca na zmianie stopnia rozdrobnienia.
2. Reakcja chemiczna (przemiana chemiczna) - przemiana, w czasie której z jednych substancji powstają inne, o odmiennych właściwościach fizycznych i chemicznych.
Przykłady:
- rdzewienie żelaza i jego stopów - powierzchnia żelaza w wilgotnej atmosferze pokrywa się jego tlenkami w postaci brunatnych plam (powstają nowe związki chemiczne - tlenki żelaza).
- kwaśnienie mleka - w czasie fermentacji niektórych cukrów zawartych w mleku powstaje kwas mlekowy (nowy związek chemiczny) nadający mleku kwaśny smak.
3. Równanie reakcji chemicznej to umowny zapis przebiegu reakcji chemicznej. Równanie reakcji informuje nas o ilości i rodzaju substancji użytych do reakcji, tzw. substratów (substancje zapisane po lewej stronie równania, przed strzałką) oraz o ilości i rodzaju substancji powstałych w jej wyniku, tzw. produktów (substancje zapisane po prawej stronie równania, za strzałką). Substraty i produkty noszą nazwę reagentów. Strzałka (→) wskazuje kierunek przebiegu reakcji.
Równanie reakcji zapisuje się za pomocą symboli i wzorów:
Podobnie jak w równaniu matematycznym, liczba i rodzaj atomów po prawej stronie równania musi być taka sama jak po lewej stronie. Dlatego też należy uzgodnić równanie reakcji czyli wpisać przed symbolami lub wzorami odpowiednie liczby, tzw. współczynniki stechiometryczne (gdy współczynnik stechiometryczny jest równy 1, nie piszemy go w równaniu), np.
Aby liczba atomów potasu była taka sama, przed KOH wpisujemy współczynnik 2:
Aby „uzgodnić” atomy wodoru (taka sama ich liczba po lewej i prawej stronie równania), wpisujemy liczbę dwa przed H2O; po prawej stronie równania mamy teraz również 4 atomy wodoru:
2KOH + H2SO4 → K2SO4 + 2H2O
Teraz sprawdzamy, czy liczba atomów tlenu jest taka sama po obu stronach równania:
Równanie zostało uzgodnione.
Jak prawidłowo należy je odczytać?
Dwie cząsteczki wodorotlenku potasu reagują z jedną cząsteczką kwasu siarkowego (VI), a w wyniku reakcji powstaje jedna cząsteczka siarczanu (VI) potasu i dwie cząsteczki wody.
Dobierz współczynniki w podanych równaniach:
1) Al + S → Al2S3
2) Na + S → Na2S
3) P + S → P2S5
4) Cu + O2 → CuO
5) C + O2 → CO2
6) Al + O2 → Al2O3
7) Cu + O2 → Cu2O
Rozwiązanie:
Uzgodnij równania w podanych przykładach (dobierz współczynniki):
1) FeO + C → Fe + CO2
2) Cu2O + H2 → Cu + H2O
3) NO2 → NO + O2
4) H2 + N2 → NH3
5) K2O + H3PO4 → K3PO4 + H2O
6) Mg (OH)2 + HCl → MgCl2 + H2O
7) CaO + CO2 → CaCO3
8) NaOH + SO3 → Na2SO4 + H2O
9) Al2O3 + HNO2 → Al(NO2)3 + H2O
Rozwiązanie:
Pogłębiaj wiedzę w temacie: Równania reakcji chemicznych
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.