zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
Reakcje przebiegają z różną szybkością (zmiana ilości substratów do produktów w jednostce czasu). Możemy wyróżnić reakcje szybkie (np. reakcje spalania) i reakcje powolne (np. powstawanie w masywach górskich jaskiń na skutek chemicznego wietrzenia skał wapiennych, trwające tysiące lat).
Szybkość reakcji to stosunek zmiany stężenia reagenta do czasu w jakim ta zmiana nastąpiła. Aby uniknąć wartości ujemnych, liczymy moduł z tego wyrażenia:
Szybkość reakcji zależy od kilku czynników:
- temperatury - szybkość reakcji rośnie ze wzrostem temperatury
- stężenia substratów - szybkość reakcji rośnie ze wzrostem stężenia substratów
- stopnia rozdrobnienia substratów - szybkość reakcji rośnie wraz ze wzrostem stopnia rozdrobnienia
- rodzaju reagujących substancji (np. bardzo szybkie reakcje jonowe), ich stanu skupienia (szybkie reakcje między gazami) oraz stopnia rozdrobnienia (im bardziej rozdrobnione substancje, tym większa szybkość reakcji)
- obecności katalizatora - substancji, która po wprowadzeniu do układu znacznie zmienia szybkość reakcji chemicznych, nie ulegając przy tym zużyciu (dlatego nie uwzględnia się go wśród substratów i produktów, a jedynie zaznacza jego obecność, pisząc symbol lub wzór nad strzałką w równaniu reakcji).
Najczęściej stosowanymi katalizatorami są: platyna w postaci rozdrobnionej (tzw. czerń platynowa) lub tlenki, np. tlenek wanadu (V2O5), tlenek manganu (MnO2).
Katalizator powodujący zmniejszanie szybkości reakcji to inhibitor.
Naturalnymi katalizatorami biorącymi udział w procesach biochemicznych są enzymy.
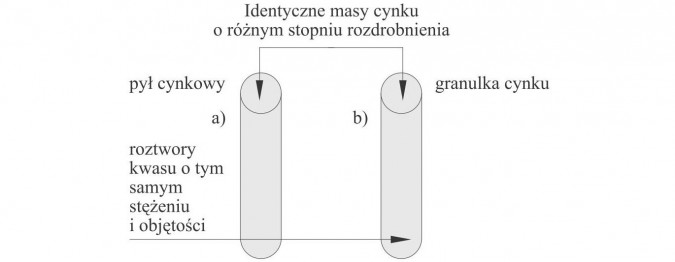
Doświadczenie 1.
Wpływ stopnia rozdrobnienia na szybkość reakcji wydzielania wodoru z kwasu solnego przez cynk.
Obserwacje: Z probówki a) szybciej wydziela sięgaz.
Wnioski: Wzrost rozdrobnienia powoduje wzrost szybkości reakcji.
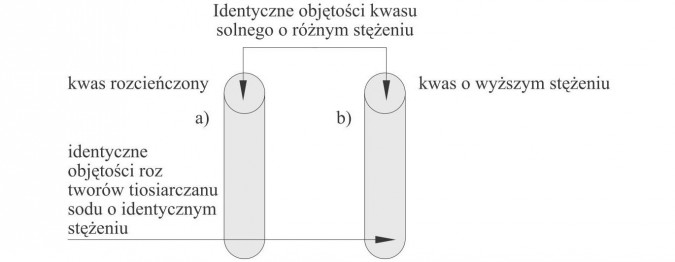
Doświadczenie 2.
Wpływ stężenia na szybkość reakcji.
Obserwacje: Z probówki b) szybciej wydziela się żółto-biały osad (siarki koloidalnej).
Wnioski: Wzrost stężenia powoduje wzrost szybkości reakcji.
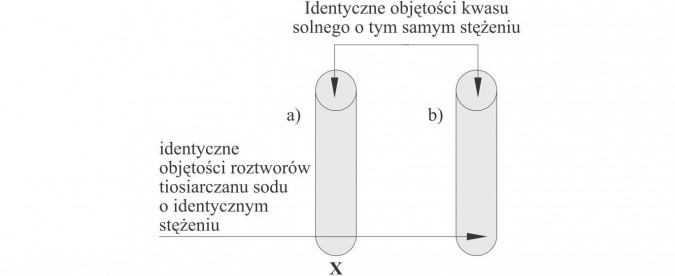
Doświadczenie 3.
Wpływ temperatury na szybkość reakcji.
Obserwacje: Z probówki a) (ogrzanej) szybciej wydziela się żółto-biały osad (siarki koloidalnej).
Wnioski: Wzrost temperatury powoduje wzrost szybkości reakcji.
EFEKTY ENERGETYCZNE TOWARZYSZĄCE PRZEMIANOM CHEMICZNYM - każdy układ (reagenty biorące udział w danej reakcji chemicznej) posiada energię, tzw. energia wewnętrzna układu. Nie można bezpośrednio wyznaczyć jej wartości, a jedynie jej zmianę, którą powoduje przekazywanie energii z układu do otoczenia (wszystko to co znajduje się poza układem) - reakcje egzoenergetyczne lub z otoczenia do układu - reakcje endoenergetyczne. Jeśli energia przekazywana jest w postaci ciepła, to mówimy o reakcjach egzotermicznych (w czasie reakcji układ przekazuje ciepło do otoczenia) i endotermicznych (reakcji chemicznej towarzyszy przekazywanie ciepła z otoczenia do układu).
Większość procesów chemicznych przebiega w układach otwartych (układ może wymieniać z otoczeniem zarówno energię, jak i masę), a nie zamkniętych (układ wymienia z otoczeniem jedynie energię). Wymianę energii w postaci ciepła pomiędzy układem otwartym a otoczeniem określa się jako zmianę entalpii układu ΔH (różnica między entalpią produktów - Hp, a entalpią substratów Hs).
Dla reakcji egzoenergetycznych ΔH < 0, dla endoenergetycznych ΔH > 0.
Pogłębiaj wiedzę w temacie: Szybkość reakcji chemicznych
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.