zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
Znajomość reguł wyznaczania stopni utlenienia pierwiastków pozwala na dokonanie elektronowej interpretacji reakcji redoks, np.:
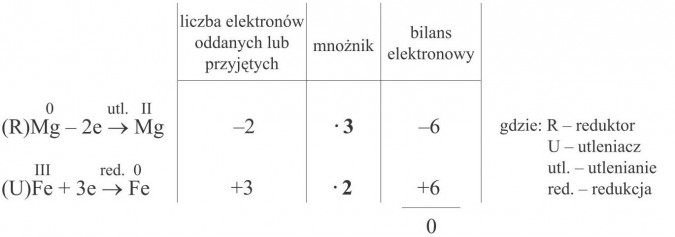
Analizując stopnie utlenienia substratów i produktów możemy stwierdzić, że w reakcji magnez podwyższył swój stopień utlenienia z 0 na II, czyli musiał oddać 2 elektrony. Żelazo obniżyło swój stopień utlenienia z III na 0, a więc przyjęło 3 elektrony. Zapisujemy to w postaci tzw. równań połówkowych, opisujących obydwie przemiany:
Proces oddawania elektronów przez atomy nosi nazwę utleniania, zaś przyjmowania - redukcji. Pierwiastek ulegający utlenianiu (podwyższający swój stopień utlenienia) jest w reakcji reduktorem, a ulegający redukcji (obniżający stopień utlenienia) to utleniacz. Procesy utleniania i redukcji zachodzą równocześnie. Ponieważ w każdej reakcji redoks liczba elektronów oddanych przez atom jednego pierwiastka musi być równa liczbie elektronów przyjętych przez atom drugiego pierwiastka, musimy zrobić „bilans elektronowy”:
Magnez oddaje w reakcji elektrony, a więc ulega utlenianiu - jest reduktorem (podwyższa stopień utlenienia z 0 na II). Żelazo przyjmując elektrony w reakcji redukcji obniża swój stopień utlenienia (z III na 0) - jest utleniaczem. Aby znaleźć współczynniki stechiometryczne reakcji, musimy zbilansować ilość elektronów. W pierwszej kolumnie na wysokości danego równania połówkowego wpisujemy liczbę oddanych (-2) i przyjętych (+3) elektronów. Ponieważ ich liczba musi być taka sama, szukamy wspólnej wielokrotności dla liczb 2 i 3, tj. 6. Liczbę oddanych elektronów mnożymy przez 3, a przyjętych przez 2. W ten sposób liczba oddanych i przyjętych elektronów została uzgodniona (jest taka sama). Liczby, przez które pomnożyliśmy ilość elektronów oddanych i przyjętych (mnożniki), służą do uzgodnienia całej reakcji redoks. Liczbę 3 znajdującą się na wysokości pierwszego równania połówkowego wpisujemy przed magnezem po lewej i prawej stronie równania reakcji. Liczbę 2 (mnożnik w drugim równaniu połówkowym) wstawiamy natomiast przed żelazem również po obu stronach równania:
Na końcu sprawdzamy, czy liczby atomów poszczególnych pierwiastków po obu stronach równania są takie same; jeśli tak, to znaczy, że równanie zostało poprawnie uzgodnione:
Należy pamiętać, że reakcjami redoks są tylko te reakcje, w których zmieniły się stopnie utlenienia atomów biorących w nich udział.
Wskaż, które z podanych reakcji są reakcjami utleniania - redukcji:
a) MgO + 2HCl → MgCl2 + H2O
b) 2KClO3 → 2KCl + 3O2
c) CO2 + C → 2CO
d) CaO + H2O → Ca(OH)2
Rozwiązanie:
Wskaż w podanych równaniach reakcji utleniacz i reduktor:
a) 2Mg + O2 → 2MgO
b) CaO + 2HCl → CaCl2 + H2O
c) 2ZnS + 3O2 → 2ZnO + 2SO2
d) 2Fe + 3S → Fe2S3
Rozwiązanie:
W oparciu o bilans elektronowy dobierz współczynniki stechiometryczne w następujących równaniach redoks:
a) HClO3 + H2SO3 → H2SO4 + HCl
b) Sb2S3 + Fe → FeS + Sb
c) CuS + HNO3 → CuO + S + NO + H2O
d) SO2 + Br2 + H2O → HBr + H2SO4
Rozwiązanie:
Pogłębiaj wiedzę w temacie: Reakcje utleniania i redukcji
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.