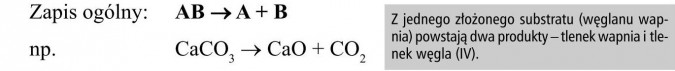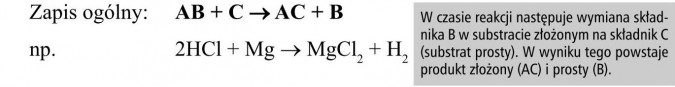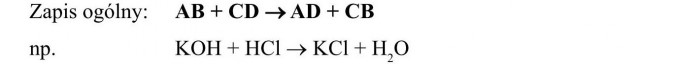zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
Ze względu na ilość substratów (substancje użyte do reakcji) i produktów (substancje powstające w wyniku reakcji) reakcje dzielimy na:
a) reakcje syntezy (łączenia) - reakcje, w których z dwu lub więcej substancji prostych powstaje jeden produkt.
b) reakcje analizy (rozkładu) - reakcje, w których z jednego złożonego substratu powstają dwa lub więcej produktów.
c) reakcje wymiany - reakcje, w których następuje wymiana składników między reagującymi substancjami.
- wymiana pojedyncza - dwie lub więcej substancji (prostych i złożonych) przekształca się w dwie lub więcej nowych substancji, z których jedna jest prosta.
- wymiana podwójna - w reakcji dwie lub więcej substancji złożonych przekształca się w inne substancje złożone.
Ułóż równania syntezy:
a) chlorku magnezu
b) siarczku potasu
c) tlenku węgla (IV)
Rozwiązanie:
Uzupełnij następujące równania reakcji i określ ich rodzaj:
a) H2S + ...... → CaS + H2
b) NaOH + HNO3 → ...... + H2O
c) Al + O2 → ......
d) MgCO3 → MgO + ......
Rozwiązanie:
Uzupełnij tabelkę:
| Substraty | Produkty | Reagenty | Równanie reakcji | Typ reakcji |
|---|---|---|---|---|
| CaO, HCl | CaO, HCl, CaCl2, H2O | |||
| Hg, O2 | Hg, O2, HgO | |||
| Mg, Cl2 | Reakcja syntezy | |||
| 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 |
Rozwiązanie:
| Substraty | Produkty | Reagenty | Równanie reakcji | Typ reakcji |
|---|---|---|---|---|
| CaO, HCl | CaCl2, H2O | CaO, HCl, CaCl2, H2O | CaO + 2 HCl → CaCl2 + H2O | Reakcja wymiany podwójnej |
| HgO | Hg, O2 | Hg, O2, HgO | 2 HgO → 2 Hg + O2 | Reakcja analizy |
| Mg, Cl2 | MgCl2 | Mg, Cl2, MgCl2 | Mg + Cl2 → MgCl2 | Reakcja syntezy |
| Al, H2SO4 | Al2(SO4)3, H2 | Al, H2SO4, Al2(SO4)3, H2 | 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 | Reakcja wymiany pojedynczej |
Omówienie:
1) Substratami w reakcji są CaO i HCl (dwa związki złożone), a więc jest to reakcja wymiany podwójnej. Spośród reagentów (wszystkie substancje uczestniczące w reakcji, zarówno substraty, jak i produkty) odrzucamy substraty i pozostają nam produkty, które w równaniu reakcji piszemy za strzałką. Ponieważ po prawej stronie równania są 2 atomy chloru, a po lewej 1, musimy w równaniu przed HCl wpisać 2 (uzgadniamy w ten sposób również atomy wodoru, po dwa po obu stronach równania). Równanie jest uzgodnione.
2) Spośród wymienionych reagentów odrzucamy produkty (piszemy je po prawej stronie równania), a więc substratem (lewa strona równania) jest HgO. Jeżeli w reakcji z jednego, złożonego związku (HgO) powstają co najmniej dwie substancje proste (rtęć i tlen), to jest to reakcja analizy. Piszemy i uzgadniamy równanie reakcji; po prawej stronie są dwa atomy tlenu, po lewej jeden - przed HgO wstawiamy 2. Aby uzgodnić teraz liczbę atomów rtęci (2 po lewej stronie, 1 po prawej), przed symbolem Hg piszemy 2. Równanie jest uzgodnione.
3) Substratami w reakcji syntezy są magnez i chlor, a więc w wyniku ich połączenia powstanie jeden produkt - chlorek magnezu. Do reagentów należą zarówno substraty, jak i produkt tej reakcji, wypisujemy je więc w odpowiedniej kolumnie.
4) Substancje znajdujące się po lewej stronie równania (przed strzałką) to substraty, po prawej - produkty. Substraty i produkty to reagenty. Równanie to jest przykładem wymiany pojedynczej; wśród substratów i produktów są substancje proste i złożone.
Pogłębiaj wiedzę w temacie: Typy reakcji chemicznych
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.