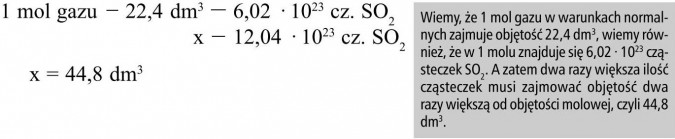zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
1 mol dowolnego gazu w warunkach normalnych (ciśnienie 1013,25 hPa, temperatura 273 K tj. 0°C) zajmuje zawsze objętość 22,4 dm3.
Vmol = 22,4 dm3/mol Vmol - objętość molowa
Prawo Avogadra - w jednakowych objętościach różnych gazów, w tych samych warunkach ciśnienia i temperatury, znajduje się taka sama liczba cząsteczek.
Prawo Gay - Lussaca (prawo stałych stosunków objętościowych) - objętości reagujących ze sobą substratów gazowych oraz powstających w reakcji gazowych produktów, odmierzone w tych samych warunkach ciśnienia i temperatury, pozostają do siebie w stosunku niewielkich liczb całkowitych.
Oblicz, jaką objętość w warunkach normalnych zajmują:
a) 3 mole wodoru cząsteczkowego
b) 0,1 mola azotu cząsteczkowego
c) 1 kilomol tlenku węgla (II)
Rozwiązanie:
Odp.: 3 mole wodoru cząsteczkowego zajmują w warunkach normalnych objętość równą 67,2 dm3.
Odp.: 0,1 mola azotu cząsteczkowego zajmuje objętość 2,24 dm3.
Odp.: 1 kilomol tlenku węgla (II) w warunkach normalnych zajmuje objętość 22400 dm3.
Oblicz, jaką liczbę moli stanowi:
a) 5,6 dm3 tlenu cząsteczkowego w warunkach normalnych
b) 11,2 dm3 tlenku siarki (VI) w warunkach normalnych
c) 1 m3 metanu w warunkach normalnych
Rozwiązanie:
Odp.: 5,6 dm3 tlenu odmierzonego w warunkach normalnych stanowi 0,25 mola.
Odp.: 11,2 dm3 tlenku siarki (VI) odmierzonego w warunkach normalnych stanowi 0,5 mola.
Odp.: 1 m3 metanu odmierzonego w warunkach normalnych stanowi ok. 44,6 mola.
Oblicz masę:
a) 224 dm3 wodoru w warunkach normalnych
b) 0,224 dm3 tlenu w warunkach normalnych
c) 1 cm3 chloru w warunkach normalnych
Rozwiązanie:
Odp.: 224 dm3 wodoru odmierzonego w warunkach normalnych waży 20 g.
Odp.: 0,224 dm3 tlenu odmierzonego w warunkach normalnych waży 0,32 g.
Odp.: 1 cm3 chloru odmierzonego w warunkach normalnych waży ok. 0,003 g.
Jaką objętość w warunkach normalnych zajmuje 12,04 · 1023 cząsteczek tlenku siarki (IV)?
Rozwiązanie:
Odp.: 12,04 · 1023 cząsteczek tlenku siarki (IV) zajmuje w warunkach normalnych objętość 44,8 dm3.
Ile gramów tlenu znajduje się w 1,12 dm3 tlenku węgla (IV) odmierzonego w warunkach normalnych?
Rozwiązanie:
Odp.: W 1,12 dm3 tlenku węgla (IV) odmierzonego w warunkach normalnych znajduje się 1,6 g tlenu.
Pogłębiaj wiedzę w temacie: Prawa gazowe
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.