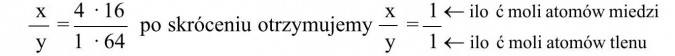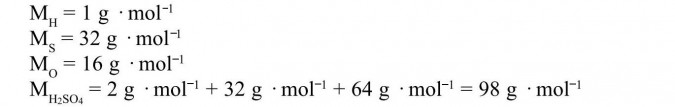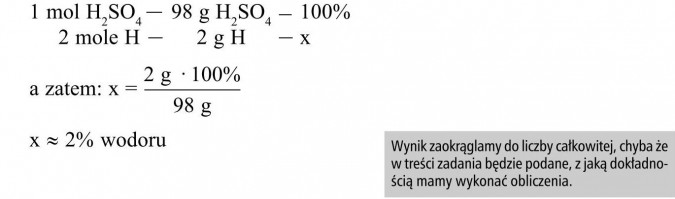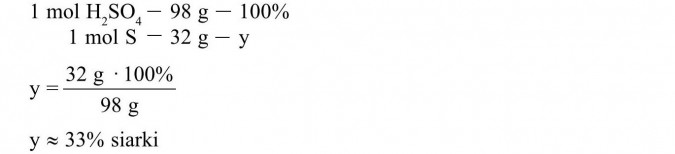zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
PRAWO STAŁOŚCI SKŁADU ZWIĄZKU CHEMICZNEGO (PRAWO STOSUNKÓW STAŁYCH) - dla danego związku chemicznego stosunek mas pierwiastków tworzących ten związek jest wielkością stałą (nie zależy od metody czy miejsca otrzymywania związku).
W oparciu o prawo stałości składu można ustalić wzór elementarny związku (jest to wzór najprostszy, podaje on rodzaj i wzajemny stosunek atomów, często odpowiada wzorowi rzeczywistemu związku).
Np.: Wiedząc, że stosunek masowy miedzi do siarki wynosi 4:1, ustal wzór związku.
Wzór tego związku możemy zapisać jako:
A zatem stosunek masowy tych pierwiastków zapiszemy jako iloczyn ilości moli atomów miedzi (x) i masy 1 mola miedzi (64 g) przez iloczyn ilości moli atomów tlenu (y) i masy 1 mola tlenu (16 g), a wynosi on 4:1 (informacja zawarta w treści zadania).
a zatem:
Podstawiamy teraz do wzoru za x i y otrzymane liczby, w naszym przypadku są to jedynki, które pomijamy, a więc otrzymujemy wzór: CuO. Ponieważ w zadaniu nie jest podana masa molowa lub cząsteczkowa związku, można jedynie ustalić wzór elementarny (najprostszy) związku.
Odp.: Związek, w którym stosunek masowy miedzi do tlenu wynosi 4:1, ma wzór CuO.
Na podstawie prawa stałości składu możemy obliczyć skład procentowy związku (tj. zawartość procentową wszystkich pierwiastków w danym związku chemicznym).
Np.: Obliczyć skład procentowy kwasu siarkowego (VI).
Rozwiązanie:
Z Układu Okresowego wypisujemy masy molowe pierwiastków wchodzących w skład kwasu oraz obliczamy masę molową H2SO4:
Masa 1 mola H2SO4 stanowi całość, tj. 100%, natomiast zawartość procentową poszczególnych pierwiastków obliczamy z proporcji:
Obliczamy zawartość procentową kolejnego pierwiastka, tj. siarki, układając proporcję i rozwiązując otrzymane równanie:
Pozostaje jeszcze do obliczenia zawartość procentowa tlenu, którą również możemy obliczyć z proporcji, jednak znacznie łatwiej i szybciej możemy to zrobić odejmując od 100% sumę zawartości procentowej obliczonych już pierwiastków (wodoru i siarki).
Odp.: W skład kwasu siarkowego (VI) wchodzi ok. 2% wodoru, 33% siarki i 65% tlenu.
Oblicz stosunek masowy magnezu do tlenu w tlenku magnezu.
Rozwiązanie:
Odp.: Stosunek masowy magnezu do tlenu w tlenku magnezu wynosi 3:2.
Oblicz stosunek masowy żelaza do tlenu w tlenku żelaza (III).
Odp.: Stosunek masowy żelaza do tlenu w tlenku żelaza (III) wynosi 7:3.
Ustal wzór związku węgla i wodoru, w którym stosunek masowy tych pierwiastków wynosi 5:1. Masa molowa związku wynosi 72 g · mol-1.
Rozwiązanie:
Odp.: Związek węgla i wodoru o masie molowej równej 72 g · mol-1 i stosunku masowym pierwiastków 5:1 ma wzór C5H12.
Ustal wzór tlenku azotu o masie cząsteczkowej 92u, wiedząc że stosunek masowy azotu do tlenu wynosi 7:16. Oblicz zawartość procentową pierwiastków.
Rozwiązanie:
Odp.: N2O4 jest wzorem tlenku azotu o masie cząsteczkowej 92u, który zawiera 30,4% azotu i 69,6% tlenu.
Oblicz, w jakim stosunku masowym łączy się węgiel z tlenem, jeżeli w wyniku spalenia 1,5 g węgla w tlenie otrzymano 5,5 g tlenku węgla (IV).
Rozwiązanie:
Odp.: Węgiel łączy się z tlenem w tej reakcji w stosunku masowym 3:8.
Pogłębiaj wiedzę w temacie: Prawo stałości składu
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.