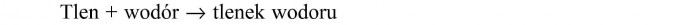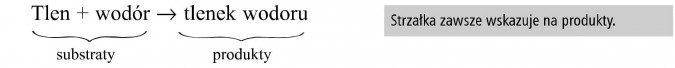zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
Tlen to bezbarwny gaz, bez smaku i zapachu, słabo rozpuszczalny w wodzie, najbardziej reaktywny z gazów atmosferycznych. Skrapla się w temperaturze -183° (skroplony ma jasnoniebieską barwę). Tlen podtrzymuje spalanie, sam się nie pali.
Obieg tlenu w przyrodzie
Tlen pobierany jest w procesie oddychania przez organizmy żywe. W wyniku oddychania łączy się z węglem w dwutlenek węgla, w połączeniu z wodorem tworzy wodę. Dwutlenek węgla jest pobierany przez rośliny. W wyniku fotosyntezy tlen zawarty w dwutlenku węgla powraca do środowiska.
Tlen, który został zawarty w wodzie wchodzi w skład organizmów żywych i po ich obumarciu powraca do środowiska.
Tlen jest niezbędny do oddychania. Tlen, którym oddychamy powoduje, że z substancji zawartych w spożywanym przez nas pokarmie wydziela się energia. Energia ta jest zużywana przez nasz organizm do wykonywania różnych czynności życiowych.
Tlen jest niezbędny do podtrzymywania procesów spalania, butwienia szczątków organizmów żywych.
Niekorzystnym dla nas działaniem tlenu jest to, że wraz z mikroorganizmami powoduje psucie się żywności.
Metale pod wpływem tlenu i wilgoci ulegają korozji, a skały procesowi wietrzenia.
Tlen łączy się z innymi pierwiastkami tworząc związki chemiczne zwane tlenkami. Proces ten zaliczamy do reakcji utleniania.
Tlen w połączeniu z wodorem tworzy tlenek wodoru. Tlenek wodoru to nazwa chemiczna wody.
W wyniku tej przemiany z tlenu i wodoru powstała nowa substancja o zupełnie innych właściwościach, zatem zaszła reakcja chemiczna.
Przebieg tej reakcji możemy zapisać:
Taki schematyczny zapis przebiegu reakcji nazywamy „słownym zapisem równania reakcji chemicznej”.
Strzałka „→” wskazuje kierunek przemiany.
Te substancje, które są przed strzałką zostały wzięte do reakcji i nazywamy je substratami.
Substancje, które są zapisane po strzałce powstały w wyniku reakcji i nazywamy je produktami.
Prawidłowy sposób odczytania zapisu:
„tlen łączy się z wodorem, w wyniku reakcji powstaje tlenek wodoru”.
Tlenki to związki chemiczne tlenu z innymi pierwiastkami.
Pogłębiaj wiedzę w temacie: Tlen
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.