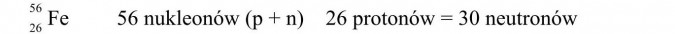zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
Każdy pierwiastek w Układzie Okresowym opisany jest dwoma liczbami, które charakteryzują skład jądra atomowego:
- liczba atomowa (Z) (zwana inaczej liczbą porządkową) podaje liczbę protonów w jądrze atomowym, a tym samym liczbę elektronów w atomie (w obojętnym atomie liczba protonów - cząstek dodatnich jest równa liczbie elektronów - cząstek ujemnych).
- liczba masowa (A) podaje liczbę nukleonów (łączną liczbę protonów i neutronów) w jądrze atomowym
gdzie:
E - symbol dowolnego pierwiastka
A - liczba masowa
Z - liczba atomowa
Aby obliczyć liczbę neutronów, należy odjąć od liczby masowej (A) liczbę atomową (Z).
Np. sód (Na) opisany jest w Układzie Okresowym dwoma liczbami, liczbą 11 znajdującą się w lewym dolnym rogu symbolu (liczba atomowa) oraz liczbą 22, 98977, którą zaokrąglamy do liczby całkowitej - 23 (liczba masowa). Liczbę masową podajemy zawsze w postaci liczby całkowitej (pamiętamy o zasadach zaokrąglania - od liczby 5 zaokrąglamy w górę). A więc:
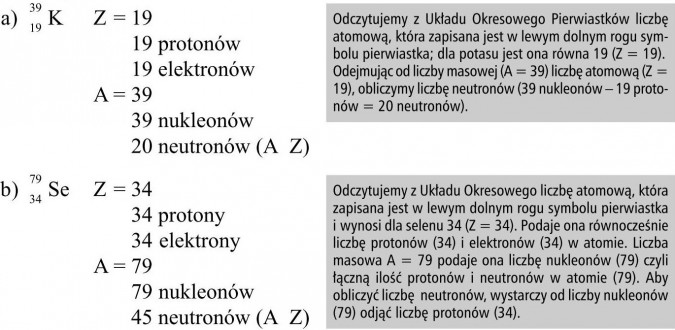
Podaj liczbę atomową i masową oraz oblicz liczbę poszczególnych cząstek elementarnych dla następujących pierwiastków:
a) potasu - nuklidu 39
b) selenu - nuklidu 79
Rozwiązanie:
Podaj liczby atomowe oraz symbole i nazwy pierwiastków zawierających podane liczby protonów:
a) 16 protonów
b) 20 protonów
Rozwiązanie:
Podaj liczbę protonów, elektronów, nukleonów oraz neutronów w następujących atomach:
Rozwiązanie:
Zadanie 4
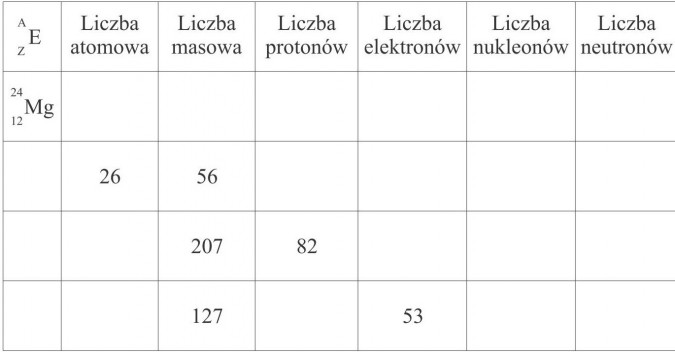
Uzupełnij tabelkę:
Rozwiązanie:
Omówienie:
Liczba atomowa znajduje się w lewym dolnym rogu symbolu pierwiastka (12), jest równa liczbie protonów (12) i elektronów (12) w atomie. Liczba masowa (24) zapisana jest w górnym rogu symbolu i podaje liczbę nukleonów (24). Aby obliczyć liczbę neutronów, trzeba od liczby masowej (liczby nukleonów) odjąć liczbę atomową (liczbę protonów), tj. 24-12=12.
b) znamy liczbę atomową pierwiastka (26), która jest równa liczbie protonów (26) i elektronów (26). Sprawdzamy w Układzie Okresowym, jaki pierwiastek ma w lewym dolnym rogu liczbę 26 - jest to żelazo (Fe). Drugą z liczb (56) opisującą pierwiastek i podającą liczbę nukleonów (56) zapisujemy w górnym lewym rogu symbolu, tj.
c) podana jest liczba protonów (82), która jest równa liczbie elektronów (82) w atomie (atom jest elektrycznie obojętny). Znając liczbę protonów znamy również liczbę atomową pierwiastka, która jest jej równa (82). Możemy więc odnaleźć pierwiastek w Układzie Okresowym, szukając liczby 82 w lewym dolnym rogu symbolu. Jest to ołów - Pb. Drugą z liczb - 207 wpisujemy w górnym lewym rogu symbolu, tj.
Liczba masowa (liczba nukleonów) wynosi więc 207, odejmując od niej liczbę atomową (liczbę protonów - 82) obliczamy liczbę neutronów (125).
d) znamy liczbę elektronów w atomie (53), ponieważ atom jest elektrycznie obojętny, musi być ona równa liczbie ładunków dodatnich - protonów (53). Taka sama jest zatem liczba atomowa (53), która zapisana jest w lewym dolnym rogu symbolu jodu. Drugą z liczb - 127 umieszczamy w lewym górnym rogu symbolu jako liczbę masową:
Liczba masowa jest równocześnie liczbą nukleonów (127), odejmując od niej liczbę protonów (53) obliczamy ilość neutronów (74) w atomie.
Pogłębiaj wiedzę w temacie: Budowa atomu a położenie pierwiastka w układzie okresowym
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.