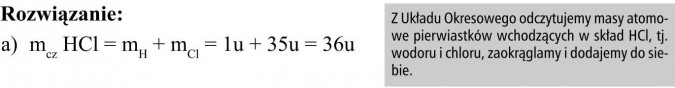zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
MASA ATOMOWA (mat.) - masa atomu wyrażona w atomowych jednostkach masy (u).
ATOMOWA JEDNOSTKA MASY (u) - jest równa 1/12 masy izotopu węgla C-12.
1u = 1,66 · 10-27 kg
Masę atomową pierwiastka odczytujemy z Układu Okresowego, zaokrąglamy do liczby całkowitej i wyrażamy w „u”, np. masa atomowa sodu (mNa) wynosi 23u.
MASA CZĄSTECZKOWA (mcz) - masa cząsteczki wyrażona w atomowych jednostkach masy (u). Chcąc obliczyć masę cząsteczkową, sumujemy masy atomowe wszystkich wchodzących w jej skład atomów, np. masa cząsteczkowa kwasu węglowego H2CO3 = 2mH + mC + 3mO = 2 · 1u + 12u + 3 · 16u = 62u
Oblicz masę cząsteczkową następujących związków:
a) HCl
b) H3PO4
c) Mg(OH)2
d) Al2(SO3)3
Oblicz, ile razy masa cząsteczkowa glukozy C6H12O6 jest większa od masy cząsteczkowej wodorotlenku sodu NaOH.
Rozwiązanie:
Odp.:
Masa cząsteczkowa glukozy jest 4,5 razy większa od masy cząsteczkowej wodorotlenku sodu.
Zadanie 3
Oblicz w gramach masę atomu radu.
Rozwiązanie:
Pogłębiaj wiedzę w temacie: Masa atomowa i cząsteczkowa
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.