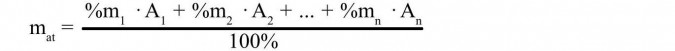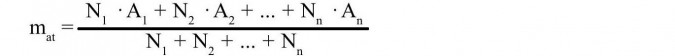zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
IZOTOPY - atomy tego samego pierwiastka o takiej samej liczbie atomowej (taka sama liczba protonów w jądrze), a różnej liczbie masowej (różna liczba neutronów w jądrze). Izotopy zajmują to samo miejsce w Układzie Okresowym (ta sama liczba atomowa). Np. izotopy węgla: węgiel dwanaście (C-12) i węgiel czternaście (C-14) o symbolach odpowiednio:
Przeanalizujmy zapisy:
Izotopy wodoru to:
Nuklid - zbiór atomów o określonej budowie jądra atomowego, tzn. o określonej liczbie protonów i neutronów w jądrze. Każdy izotop jest nuklidem.
Większość pierwiastków występujących w przyrodzie to mieszaniny ich izotopów o stałym składzie ilościowym.
Tylko nieliczne pierwiastki (np. glin, jod, fluor, sód) nie mają izotopów.
Masa atomowa pierwiastka jest dla pierwiastków występujących w przyrodzie w postaci mieszaniny izotopowej średnią masą atomową wynikającą z procentowej zawartości jego izotopów, którą można obliczyć ze wzoru:
gdzie: mat - masa atomowa pierwiastka
A1, A2 , An - liczby masowe poszczególnych izotopów
% m1, % m2, % mn - procentowe zawartości poszczególnych izotopów
lub:
gdzie: mat - masa atomowa pierwiastka
A1, A2 , An - liczby masowe poszczególnych izotopów
N1, N2, Nn - ilości izotopów poszczególnych atomów w próbce
np. węgiel jest mieszaniną dwóch izotopów:
Podstawiamy do wzoru zawartość procentową izotopu C-12 wynoszącą 98,89% i mnożymy ją przez jego masę atomową (12u), do tego dodajemy zawartość procentową drugiego izotopu węgla C-13, wynoszącą 1,11% pomnożoną przez jego masę atomową (13u). Licznik dzielimy przez 100 (procenty się skracają) i otrzymujemy masę atomową węgla (12,011) wyrażoną w atomowych jednostkach masy (u).
Powyższy przykład wyjaśnia, dlaczego masy atomowe większości pierwiastków nie są liczbami całkowitymi.
Zastosowanie izotopów:
- przemysł energetyczny (elektrownie jądrowe), np. 239Pu i 235U
- medycyna (terapia nowotworowa), np. 226Ra i 60Co
- oznaczanie wieku wykopalisk w badaniach archeologicznych i geologicznych - 14C
- badanie procesów fizycznych i chemicznych, np. 18O
- sterylizacja żywności - 60Co
- diagnostyka stanu technicznego i wykrywanie wad w urządzeniach przemysłowych, np. 137Cs i 60Co
Podaj liczbę poszczególnych cząstek elementarnych w atomach wapnia - 40 i wapnia - 44.
Rozwiązanie:
Wybierz spośród podanych nuklidów zbiory izotopów i podaj ich nazwę:
Rozwiązanie:
Izotopy są to odmiany pierwiastka o takiej samej liczbie atomowej, a różnej masowej. Wśród podanych nuklidów możemy wyróżnić zatem 3 grupy izotopów:
a) węgiel - 13
b) miedź - 65
c) wodór - 3
Rozwiązanie:
Podaj symbol, liczbę atomową i liczbę masową izotopów zawierających:
a) 35 elektronów i 79 nukleonów oraz 35 elektronów i 81 nukleonów
b) 10 elektronów i 10 neutronów oraz 10 elektronów i 12 neutronów
c) 7 protonów i 7 neutronów oraz 7 protonów i 8 neutronów
Rozwiązanie:
Pogłębiaj wiedzę w temacie: Izotopy
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.