zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
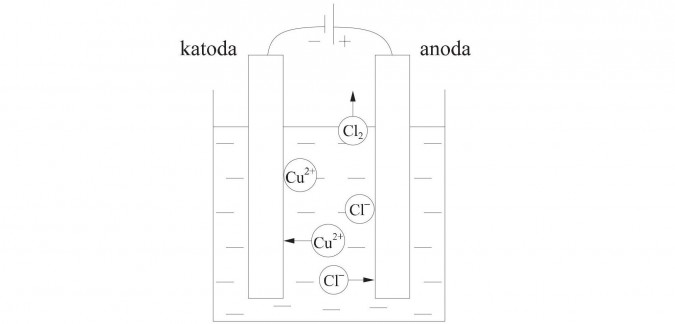
Wodne roztwory soli są elektrolitami, czyli przewodzą prąd elektryczny. W tych roztworach znajdują się jony dodatnie i ujemne powstałe w wyniku dysocjacji elektrolitycznej soli. Jeżeli w takim roztworze umieścimy dwie elektrody podłączone do źródła prądu stałego, to jony będą się przemieszczały w kierunku elektrody o przeciwnym ładunku do ładunku jonu.
Katoda to elektroda ujemna, anoda to elektroda dodatnia.
Reakcje zachodzące na elektrodach w czasie przepływu prądu elektrycznego przez elektrolit nazywamy elektrolizą.
W naczyniu znajduje się CuCl2 (chlorek miedzi (II)), który pod wpływem wody ulega dysocjacji, czyli rozpadowi na jony.
Jony to cząstki obdarzone ładunkiem dodatnim lub ujemnym.
W roztworze zanurzamy dwie elektrody połączone ze źródłem prądu.
Jony dodatnie Cu2+ (kationy) przesuwają się w kierunku katody, czyli elektrody ujemnej.
Ładunki przeciwne przyciągają się.
Kationy Cu2+ przyjmują od elektrody ujemnej elektrony i ładunek ich się zobojętnia.
Jony ujemne Cl- (aniony) przesuwają się w kierunku elektrody dodatniej, czyli anody. Oddadzą anodzie swoje elektrony i ich ładunek się zobojętni.
Chlor występuje w postaci dwuatomowych cząsteczek, czyli dwóch atomów połączonych razem, dlatego piszemy Cl2
Po kilku minutach przy anodzie będzie wydzielał się gazowy chlor, a katoda pokrywa się warstewką czystej miedzi.
Elektroliza znalazła zastosowanie do:
- pokrywania powierzchni cieniutką warstewką metalu, np. klamki są chromowane,
- otrzymywania czystych metali,
- otrzymywania czystych gazów.
Pogłębiaj wiedzę w temacie: Elektroliza soli
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.