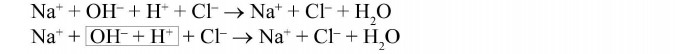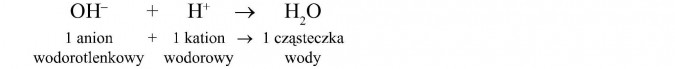zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
Znanych jest wiele metod otrzymywania soli. Aby łatwiej je zapamiętać, można posłużyć się tabelą.
W poziomym rzędzie piszemy nazwy grup poznanych związków, które w swoich cząsteczkach zawierają metale: metal, tlenek metalu, wodorotlenek, sól.
W pionowej kolumnie piszemy nazwy grup poznanych związków, które w swoich cząsteczkach zawierają niemetale: niemetal, tlenek niemetalu, kwas, sól.
Każda substancja w pionowej kolumnie w reakcji z każdą substancją w poziomym rzędzie daje sole.
Powinieneś znać metody otrzymywania soli w ponumerowanych kratkach, a szczególnie dokładnie najczęściej stosowane metody 4, 5, 6 (kwasu z metalem, kwasu z tlenkiem metalu, kwasu z wodorotlenkiem).
| metal | tlenek metalu | wodorotlenek | sól | |
| niemetal | 1 | |||
| tlenek niemetalu | 2 | 3 | ||
| kwas | 4 | 5 | 6 | 7 |
| sól | 8 | 9 |
Uzupełniając równania reakcji otrzymywania soli należy dobrać współczynniki stechiometryczne (liczby stojące przed symbolem pierwiastka lub wzorem związku chemicznego) w następującej kolejności:
- zapisać wzory substratów i produktów (substancji wziętych do reakcji i otrzymanych w wyniku reakcji),
- wyrównać liczbę atomów metalu (przed reakcją i po reakcji ma być taka sama),
- wyrównać liczbę reszt kwasowych,
- wyrównać liczbę atomów wodoru.
W metodzie tej do reakcji bierzemy taki tlenek niemetalu, który jest bezwodnikiem kwasu o reszcie kwasowej takiej samej jak w powstającej soli. Jeżeli ma powstać np. siarczan (VI), to do reakcji bierzemy bezwodnik kwasu siarkowego (VI), czyli tlenek siarki (VI) o wzorze SO3.
Wartościowość niemetalu w kwasie i w tlenku niemetalu (bezwodniku) jest taka sama.
W reakcji tej cynk wyparł wodór z kwasu i wszedł na jego miejsce.
Nie wszystkie metale mają jednakową zdolność do wypierania wodoru z roztworu kwasu.
Metale ułożono w szereg według ich zdolności wypierania wodoru z kwasu. Szereg ten nazwano szeregiem aktywności metali.
Metale, które są umieszczone przed wodorem (na początku szeregu) wypierają wodór z kwasów. Zdolności tej nie mają metale stojące za wodorem.
Przykład
Reakcję tę możemy zapisać w formie jonowej, ponieważ kwasy i zasady w roztworze wodnym ulegają dysocjacji.
Po obu stronach równania znajdują się te same jony Na+ i Cl-, nie uczestniczą one w reakcji.
Traktując równanie reakcji jak równanie matematyczne możemy odjąć te jony od obu stron równania i w efekcie otrzymamy:
W wyniku oddziaływania (przyciągania) jonów o przeciwnych ładunkach powstaje elektrycznie obojętna cząsteczka wody. Odczyn powstałego roztworu jest obojętny.
Za odczyn kwaśny odpowiadają jony H+, za zasadowy jony OH-. W reakcji kwasów z zasadami liczba jonów H+ jest taka sama jak liczba jonów OH-, dlatego odczyn jest obojętny.
Reakcję kwasu z zasadami nazywamy reakcją zobojętniania.
Zasady to wodorotlenki, które rozpuszczają się w wodzie.
Przykłady reakcji zobojętniania:
Zapis cząsteczkowy:
Zapis jonowy:
Zapis cząsteczkowy:
Zapis jonowy:
Sole mogą reagować z niektórymi zasadami. W reakcji tej obydwa substraty (sól i wodorotlenek) i jeden produkt (inna sól lub inna zasada) muszą być rozpuszczalne.
Dzięki temu możemy oddzielić powstającą sól od powstającego wodorotlenku.
Przykład
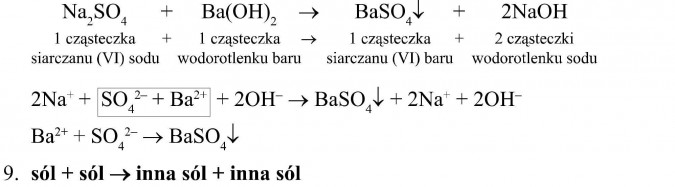
W wyniku zmieszania dwóch roztworów soli dobrze rozpuszczalnych w wodzie może powstać trzecia sól, która charakteryzuje się słabą rozpuszczalnością, więc powstanie w postaci osadu. Jest to reakcja strąceniowa.
Przykład
Pogłębiaj wiedzę w temacie: Otrzymywanie soli
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.