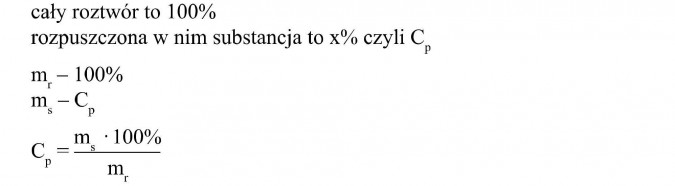zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
Stężenie roztworu określa zawartość substancji rozpuszczonej w jednostce masy lub objętości roztworu.
Istnieje szereg sposobów wyrażania stężeń roztworów.
Jeżeli zawartość substancji w roztworze wyrażamy w procentach, to wtedy mówimy o stężeniu procentowym.
Jeżeli roztwór jest 20-procentowy, to znaczy, że w 100 gramach roztworu jest 20 gramów substancji, a reszta, czyli 80 gramów to rozpuszczalnik.
Jeżeli oznaczymy:
mw = masa rozpuszczalnika
mr = masa roztworu
ms = masa substancji rozpuszczonej
Cp = stężenie procentowe roztworu
to stężenie procentowe możemy obliczyć z proporcji
Wynika z tego, że aby obliczyć stężenie procentowe, musimy znać masę rozpuszczonej substancji i masę całego roztworu.
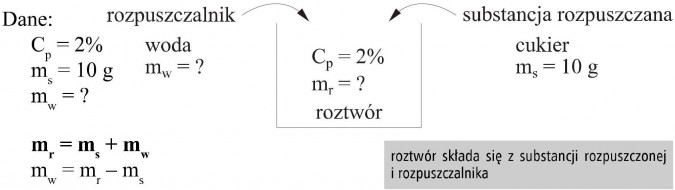
Roztwór składa się z rozpuszczalnika i substancji rozpuszczonej, zatem:
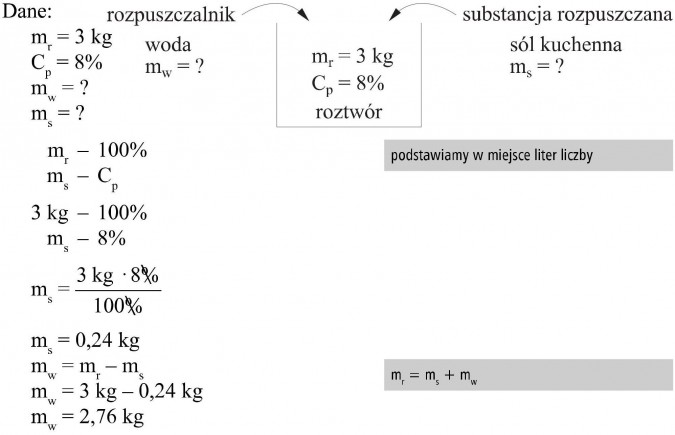
mr = ms + mw
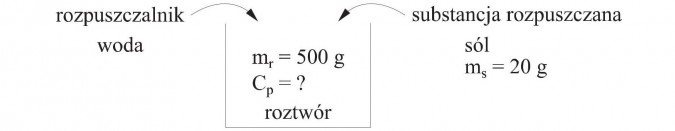
Kucharka rozpuściła w wodzie 20 g soli i otrzymała 500 g roztworu. Oblicz stężenie procentowe tego roztworu.
Rozwiązując zadania należy najpierw wypisać dane, czyli wiadomości, jakie możemy wyczytać z treści zadania.
W tym zadaniu
- substancją rozpuszczoną jest sól i jest jej 20 gramów, zapiszemy to: ms = 20 g
- rozpuszczalnikiem jest woda, ale nie jest podane, ile jej użyto
- roztworem jest sól rozpuszczona w wodzie i jest go 500 gramów, zapiszemy to: mr = 500 g
Szukaną wielkością, jaką mamy obliczyć jest stężenie procentowe, zapiszemy to Cp = ?
Przy rozwiązywaniu zadań można pomóc sobie rysunkiem.
Korzystamy z zależności
Odp.: Stężenie tego roztworu wynosi 4%.
Ile gramów wody zawiera 2% roztwór, w którym rozpuszczono 10 gramów cukru?
Masę substancji mamy podaną, wynosi 10 g, ale nie znamy masy roztworu.
Znając stężenie procentowe i masę substancji możemy obliczyć masę roztworu z zależności:
Teraz mamy już wszystkie potrzebne wielkości do obliczenia masy wody
Odp.: Roztwór ten zawiera 490 gramów wody.
Do kiszenia ogórków należy przygotować 3 kg 8-procentowego roztworu soli kuchennej. Oblicz, jaka ilość wody i soli jest potrzebna do przygotowania tego roztworu.
Odp.: Do przygotowania tego roztworu należy użyć 0,24 kg soli kuchennej i 2,76 kg wody.
Do tak przygotowanego roztworu (jak w poprzednim zadaniu) kucharka dolała 1 litr wody. Jakie będzie stężenie roztworu? 1 litr wody waży 1 kg.
Dane:
Cp = 8%
ms = 0,24 kg
mw = 2,76 kg
Odp.: Po dolaniu wody stężenie roztworu wynosi 6%.
Ile gramów wody trzeba odparować z 500 g 10-procentowego roztworu soli, aby otrzymać roztwór 15-procentowy?
Dane:
mrI = 500 g
CpI = 10%
CpII = 15%
Odp.: Trzeba odparować 167 g wody.
Ile gramów kwasu siarkowego znajduje się w 200 cm3 roztworu o stężeniu 50%? Gęstość tego roztworu wynosi 1,5 g/cm3.
Zależność między masą, objętością i gęstością substancji opisuje wzór:
Jeżeli zależność dotyczy całego roztworu, to przyjmuje się oznaczenia:
Jeżeli zależność dotyczy rozpuszczalnika, to przyjmuje się oznaczenia:
Dane:
Odp.: W tym roztworze znajduje się 150 g kwasu siarkowego.
Oblicz masę spirytusu salicylowego, czyli 2% roztworu kwasu salicylowego w alkoholu, do którego otrzymania zużyto 124 cm3 alkoholu o gęstości 0,8g/cm3.
Dane:
Cp = 2%
Vw = 124 cm3
dw = 0,8 g/cm3
Odp.: Otrzymano 101,2 g spirytusu salicylowego.
Ilu procentowy roztwór otrzymano, jeżeli zmieszano ze sobą 20 g 5-procentowego roztworu i 10 g 15-procentowego roztworu pewnej substancji?
Odp.: Po zmieszaniu otrzymano roztwór 8,3 procentowy.
Pogłębiaj wiedzę w temacie: Proces krystalizacji
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.