zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
W danej ilości rozpuszczalnika nie można rozpuścić nieograniczonej ilości roztworu (w szklance wody nie rozpuścisz 2 kilogramów cukru). Istnieje pewna granica, po której przekroczeniu nawet minimalna ilość substancji dodana do roztworu pozostanie w nim nierozpuszczona (powstaje roztwór nasycony).
Maksymalną ilość substancji, jaką można rozpuścić w danej temperaturze i pod stałym ciśnieniem w 100 g rozpuszczalnika nazywamy rozpuszczalnością.
Dla różnych substancji wyznaczono zależności między temperaturą a rozpuszczalnością w wodzie, a wyniki zebrano na wykresach. W ten sposób powstały krzywe rozpuszczalności, których znajomość pozwala sporządzić roztwory nasycone (rys. 1 str. 74).
Porównując krzywe dla różnych substancji stałych stwierdzamy, że rozpuszczalność zależy od rodzaju substancji i temperatury.
Dla większości substancji rozpuszczalność rośnie wraz ze wzrostem temperatury.
Im wyższa temperatura, tym więcej substancji możemy rozpuścić w danej objętości wody.
Rozpuszczalność substancji ciekłych w wodzie też przeważnie wzrasta wraz ze wzrostem temperatury.
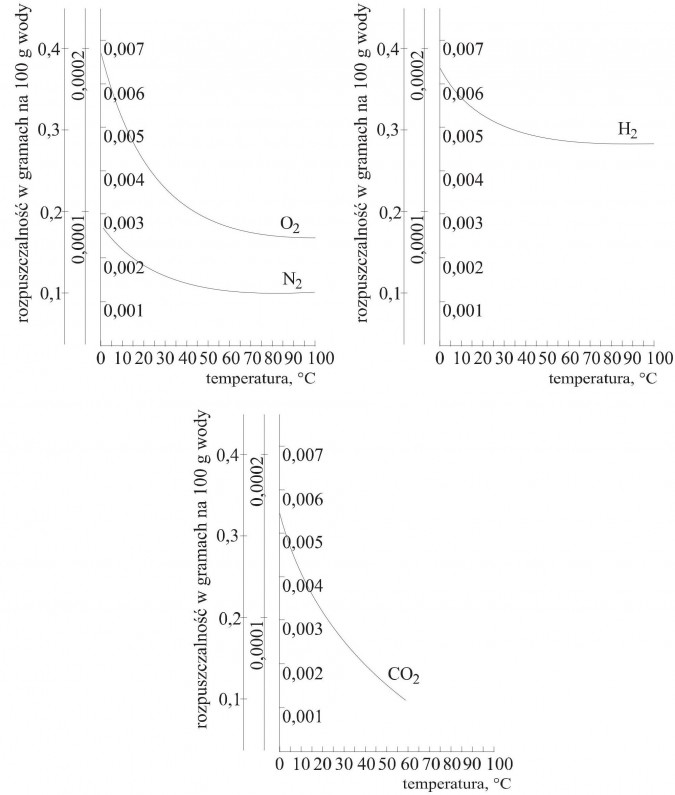
Rozpuszczalność gazów zależy od rodzaju substancji, temperatury i ciśnienia.
Wyznaczono krzywe rozpuszczalności wybranych gazów w wodzie (rys. 2 str. 75) i stwierdzono, że rozpuszczalność gazów wraz ze wzrostem temperatury maleje.
Do rozwiązania tych zadań potrzebny jest wykres krzywych rozpuszczalności substancji (rys. 1 str. 74).
Podgrzewając napój gazowany zauważamy, że gaz ucieka. Nie może się rozpuszczać w wodzie, więc się ulatnia.
Odczytaj z wykresu, w jakiej temperaturze rozpuszczalność KClO4 wynosi 20 g na 100 g wody (RKClO4 = 20 gS/100 g H2O).
Na osi rozpuszczalności (pionowej) szukamy liczby 20 i od tej liczby prowadzimy linię poziomą do przecięcia się z wykresem KClO4. Od punktu przecięcia prowadzimy linię pionową do osi temperatury i w punkcie przecięcia z tą osią odczytujemy liczbę. Liczba ta podaje nam temperaturę w stopniach Celsjusza.
Rozpuszczalność KClO4 w temperaturze 90°C wynosi 20 g na 100 g wody (możemy zapisać 20 g/100 g H2O).
Rozpuszczalność której substancji rośnie najszybciej w przedziale temperatur od 70°C do 90°C?
Patrzymy, który wykres jest najbardziej pionowy (stromy).
W podanym zakresie temperatur najszybciej rośnie rozpuszczalność KNO3.
Temperatura nasyconego roztworu NaNO3 wynosi 40°C. Jaki roztwór otrzymamy, jeżeli:
a) oziębimy go o 10°C?
b) podgrzejemy go do temperatury 100°C?
Rozwiązanie:
a)
- odczytujemy z wykresu rozpuszczalność NaNO3 w temperaturze 40°C
rozpuszczalność wynosi 110 g/100 g H2O
- odczytujemy z wykresu rozpuszczalność NaNO3 po oziębieniu czyli w temperaturze
40°C - 10°C = 30°C
rozpuszczalność wynosi 100 g/100 g H2O
- po oziębieniu ilość substancji w roztworze się nie zmieniła, dalej jest w nim 110 g NaNO3. W temperaturze 30°C do nasycenia roztworu potrzeba tylko 100 g NaNO3. Jest zatem (110 g - 100 g = 10 g) o 10 g substancji za dużo.
Odp.: Otrzymamy roztwór, w którym jest za dużo substancji, zachodzi w nim proces krystalizacji.
b)
- odczytujemy z wykresu rozpuszczalność NaNO3 w temperaturze 40°C
rozpuszczalność wynosi 110 g/100 g H2O
- odczytujemy z wykresu rozpuszczalność NaNO3 w temperaturze 100°C
rozpuszczalność wynosi 180 g/100 g H2O
- zanim roztwór ogrzano, było w nim 110 g substancji i po ogrzaniu ta ilość się nie zmieniła.
Aby w 100°C roztwór był nasycony, potrzeba 180 g substancji, a jest tylko 110 g. Wynika z tego, że jest za mało substancji. Otrzymany roztwór jest więc nienasycony.
Odp.: Otrzymany roztwór jest nienasycony.
Ile gramów KI można dodatkowo rozpuścić w 100 g wody po ogrzaniu od 10°C do 30°C, aby roztwór nadal był nasycony?
- Odczytujemy z wykresu rozpuszczalność KI w 10°C
Rozpuszczalność wynosi 140 g na 100 g wody, możemy to zapisać 140 g/100 g H2O.
- Odczytujemy z wykresu rozpuszczalność KI w 30°C
Rozpuszczalność wynosi 155 g na 100 g wody, możemy to zapisać 155 g/100 g H2O.
- Obliczamy ilość substancji, jaką można dodatkowo rozpuścić.
155 g - 140 g = 15 g
Odp.: Dodatkowo można rozpuścić 15 g KI.
Czy roztwór otrzymany przez rozpuszczenie 60 g KNO3 w 50 g wody będzie w temperaturze 70°C roztworem nasyconym?
- Odczytujemy rozpuszczalność KNO3 w temperaturze 70°C. Wynosi ona 140 g na 100 g wody.
- Obliczamy, ile KNO3 potrzeba rozpuścić w tej temperaturze w 50 g wody, aby otrzymać roztwór nasycony.
140 g KNO3 nasyca 100 g wody
x g KNO3 nasyca 50 g wody
Roztwór będzie nasycony, gdy rozpuścimy 70 g KNO3 w 50 g wody w temperaturze 70°C.
- Porównujemy ilości rozpuszczonego KNO3
Należy rozpuścić 70 g KNO3, a rozpuszczono tylko 60 g KNO3. Zatem jest za mało substancji, czyli roztwór jest nienasycony.
Odp.: Otrzymany roztwór nie będzie roztworem nasyconym.
Ile wody i ile CuSO4 należy użyć, aby w temperaturze 40°C uzyskać 50 g roztworu nasyconego?
- Odczytujemy z wykresu rozpuszczalność CuSO4 w temperaturze 40°C.
Rozpuszczalność wynosi 30 g na 100 g wody. Oznacza to, że roztwór jest nasycony, gdy rozpuścimy 30 g CuSO4 w 100 g wody. Masa całego roztworu wynosi wtedy:
Masa CuSO4 + masa wody = 30 g + 100 g = 130 g roztworu
- Obliczamy, ile CuSO4 należy użyć do otrzymania 50 g roztworu nasyconego:
30 g CuSO4 nasyca 130 g roztworu
x g CuSO4 nasyca 50 g roztworu
Rys. 1. Krzywe rozpuszczalności wybranych substancji w wodzie
- Obliczamy ilość użytej wody;
Masa wody = masa roztworu - masa substancji.
Masa wody = 50 g - 11,5 g = 38,5 g
Odp.: Aby otrzymać 50 g nasyconego w temperaturze 40°C roztworu CuSO4 należy użyć 38,5 g wody i 11,5 g CuSO4.
Rys. 2. Krzywe rozpuszczalności wybranych gazów w wodzie
Pogłębiaj wiedzę w temacie: Rozpuszczalność substancji w wodzie - zadania
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.