zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
WIĄZANIE KOWALENCYJNE (ATOMOWE) powstaje w wyniku uwspólnienia jednej lub kilku par elektronowych wiążących się atomów, w wyniku czego każdy z nich zachowuje się tak, jakby miał trwałą konfigurację gazu szlachetnego.
Różnica elektroujemności 0 ≤ ΔE < 0,4.
Budowa cząsteczki Cl2
Zaczynamy od napisania konfiguracji elektronowej atomów tworzących cząsteczkę (2 atomy chloru).
17Cl: K2 L8 M7
Różnica elektroujemności pomiędzy wiążącymi się atomami jest równa zero (każdy z atomów ma taką samą elektroujemność, są to atomy tego samego pierwiastka), a zatem w cząsteczce tworzy się wiązanie kowalencyjne. Cząsteczki zbudowane z atomów tego samego rodzaju nazywamy cząsteczkami homoatomowymi, np. O2, Br2, H2.
A zatem rysujemy schemat przedstawiający dwa atomy chloru, każdy ze swoimi siedmioma elektronami walencyjnymi (w postaci kropek):
Każdy z atomów chloru ma siedem elektronów walencyjnych, a więc do uzyskania trwałej konfiguracji gazu szlachetnego (tj. 8 elektronów walencyjnych) brakuje im po 1 elektronie. A zatem tylko jeden z elektronów każdego atomu chloru uczestniczy w utworzeniu jednej wspólnej pary elektronowej. Rysujemy go w środku cząsteczki przy każdym z atomów, pozostałe elektrony rysujemy parami, symetrycznie dookoła.
Każdą z par elektronów można zastąpić kreską - otrzymujemy tzw. wzór elektronowy kreskowy:
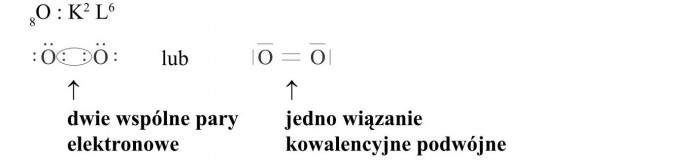
Budowa cząsteczki O2
Atomy tlenu mają 6 elektronów walencyjnych, a więc do oktetu brakuje im po dwa elektrony. Utworzą zatem dwie wspólne pary elektronowe, które rysujemy w postaci 2 kropek przy każdym z atomów w środku cząsteczki.
Pozostałe cztery rozmieszczamy parami dookoła.
Wiązania kowalencyjne mogą być utworzone z pomocą jednej wspólnej pary elektronowej - wiązanie pojedyncze lub za pomocą kilku (dwie wspólne pary elektronowe - wiązanie podwójne, trzy wspólne pary elektronowe - wiązanie potrójne).
Budowa cząsteczki SiH4
Jest to cząsteczka heteroatomowa (cząsteczka zbudowana z atomów różnych pierwiastków).
Piszemy konfiguracje elektronową atomów wchodzących w skład cząsteczki, tj. krzemu i wodoru:
14Si : K2 L8 M4
1H : K1
Odczytujemy z tablicy Elektroujemności Paulinga lub z Układu Okresowego Pierwiastków wartości elektroujemności (E) krzemu i wodoru:
ESi = 1,8
EH = 2,1
Obliczamy różnicę elektroujemności (ΔE) zawsze odejmując od większej liczby mniejszą:
ΔE = 2,1 - 1,8
ΔE = 0,3 ⇒ wiązanie kowalencyjne
W przypadku cząsteczek heteroatomowych centralnie rysujemy atom pierwiastka, który występuje pojedynczo, tj. krzemu, wokół niego rozmieszczamy cztery atomy wodoru, każdy z 1 elektronem (rysujemy go pomiędzy atomem krzemu i wodoru):
Wzór kreskowy ma postać:
Omów budowę następujących cząsteczek:
a) H2
b) N2
c) Br2
d) H2Se
e) PH3
Rozwiązanie:
Pogłębiaj wiedzę w temacie: Wiązanie kowalencyjne (atomowe)
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.