zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
WIĄZANIE KOWALENCYJNE SPOLARYZOWANE - powstaje w cząsteczkach, w których różnica elektroujemności między łączącymi się atomami wynosi od 0,4 do 1,7.
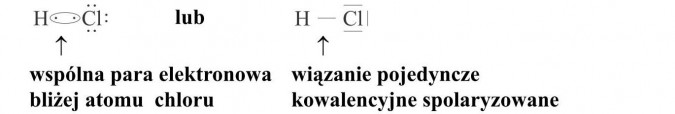
Budowa cząsteczki HCl
Aby stwierdzić, jaki rodzaj wiązania występuje w cząsteczce, obliczamy różnicę elektroujemności między wiążącymi się atomami.
EH = 2,1
ECl = 3,0
ΔE = 0,9 ⇒ wiązanie kowalencyjne spolaryzowane
1H : K1
17Cl : K2 L8 M7
Wiedząc, że atom wodoru ma jeden elektron walencyjny, rysujemy go od strony atomu chloru, przy którym od strony atomu wodoru rysujemy również jeden elektron (chlor ma 7 elektronów walencyjnych, a więc do uzyskania oktetu potrzebny mu jeden). Powstaje jedna wspólna para elektronowa - jedno wiązanie. Pozostałych sześć elektronów w atomie chloru rozmieszczamy dookoła parami (nie biorą udziału w tworzeniu wiązań).
Ponieważ różnica elektroujemności między wiążącymi się atomami jest znaczna, następuje przesunięcie wspólnej pary elektronowej w stronę pierwiastka o większej elektroujemności, w tym przypadku chloru.
Cząsteczka jako całość pozostaje nadal obojętna, ale wewnątrz następuje nierównomierny rozkład ładunku: przy atomie chloru (atom o większej elektroujemności) gromadzi się ładunek ujemny, a przy atomie wodoru (atom o mniejszej elektroujemności) ładunek dodatni. Taką dwubiegunową cząsteczkę nazywamy dipolem.
Miarą przesunięcia ładunku elektrycznego jest moment dipolowy (μ). Jego brak (μ = 0) świadczy o symetrycznej budowie cząsteczki, np. w przypadku cząsteczki liniowej AB2 (np. CO2):
Różny od zera moment dipolowy np. dla cząsteczki AB2 (H2O) świadczy o jej nieliniowej budowie:
Związki chemiczne, których cząsteczki mają różny od zera moment dipolowy nazywamy związkami polarnymi, np. H2O.
Budowa cząsteczki wody - H2O
Obliczamy różnicę elektroujemności między atomami wodoru i tlenu:
EH = 2,1
EO = 3,5
ΔE = 1,4 ⇒ wiązanie kowalencyjne spolaryzowane
W cząsteczce wody kąt między wiązaniami wynosi ok. 104°, a więc cząsteczka ma budowę kątową, a nie liniową:
Każdy z atomów wodoru ma jeden elektron walencyjny, więc aby uzyskać dublet, potrzebuje jednego elektronu od atomu tlenu (który dzięki temu będzie zachowywał się tak jakby miał oktet, uwspólni dwa elektrony). Utworzą się dwie wspólne pary elektronowe (dwa wiązania wodór - tlen), które będą przesunięte w stronę atomu tlenu (atom o większej elektroujemności). Na jednym końcu cząsteczki, przy atomie tlenu, powstanie zatem biegun ujemny, na drugim, przy atomach wodoru, biegun dodatni. Niesymetryczny rozkład ładunku powoduje polarność cząsteczki wody.
WIĄZANIE KOWALENCYJNE SPOLARYZOWANE powstaje w wyniku uwspólnienia jednej lub kilku par elektronowych przesuniętych w stronę atomu o większej elektroujemności.
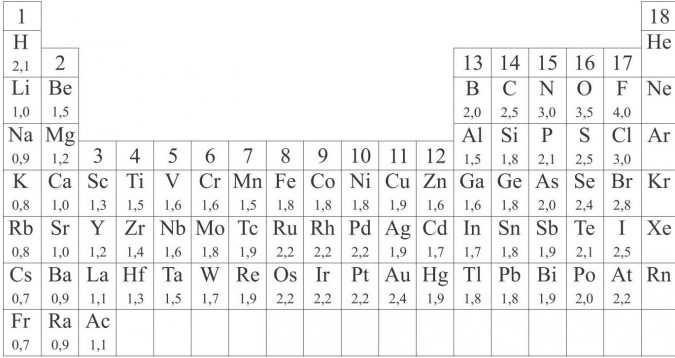
Elektroujemność pierwiastków wg Paulinga
Narysuj schematy tworzenia się wiązań w następujących cząsteczkach:
a) NH3
b) H2S
c) CO2
d) HBr
Rozwiązanie:
a) EN = 3,0
EH = 2,1
ΔE = 0,9 ⇒ wiązanie kowalencyjne spolaryzowane
Pogłębiaj wiedzę w temacie: Wiązanie kowalencyjne spolaryzowane
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.