zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
Wszystkie kwasy mają podobne właściwości chemiczne. Za jednakowe właściwości odpowiedzialne są jony charakterystyczne dla kwasów, czyli kationy wodoru.
Kwasy mają odczyn kwaśny, ich wodne roztwory zmieniają barwę wskaźników w charakterystyczny sposób:
- papierka uniwersalnego z żółtej na czerwoną,
- wywaru z czerwonej kapusty z fioletowej na czerwoną,
- oranżu metylowego z żółto-pomarańczowej na czerwoną,
- lakmusu z fioletowej na czerwoną,
- fenoloftaleina nie zmienia zabarwienia (pozostaje bezbarwna).
Kwasy reagują z większością metali i z tlenkami metali. W wyniku tych reakcji powstają związki chemiczne nazywane solami (dowiesz się o nich w następnych rozdziałach książki).
Najważniejszym związkiem chloru jest jego związek z wodorem, czyli chlorowodór HCl. Jest to gaz o ostrej, duszącej woni, bardzo dobrze rozpuszczalny w wodzie.
Wodny roztwór chlorowodoru nazywamy kwasem chlorowodorowym lub kwasem solnym (nazwa zwyczajowa pochodzi od tego, że kwas solny otrzymywano z soli kamiennej).
Jeżeli w 100 gramach roztworu chlorowodoru w wodzie znajduje się około 36 gramów czystego chlorowodoru, to taki kwas nazywamy stężonym kwasem solnym. Największe stężenie tego kwasu nie przekracza 40%.
Kwas solny jest bezbarwną, dymiącą cieczą. Stężony kwas solny pozostawiony na powietrzu w otwartym naczyniu wydziela białe, gęste opary podobne do białego dymu. Opary te powstają z gazowego chlorowodoru ulatniającego się ze stężonego roztworu oraz z pary wodnej zawartej w powietrzu. Chlorowodór pochłania momentalnie wilgoć z powietrza tworząc drobniutkie kropelki kwasu solnego, które zawieszone w powietrzu tworzą białą gęstą mgłę.
Unoszący się nad stężonym roztworem kwasu chlorowodór należy do silnych trucizn i wywołuje podrażnienie błon śluzowych.
Rozcieńczony roztwór tego kwasu występuje w soku żołądkowym człowieka. Ułatwia on trawienie. Zmiana stężenia kwasu w soku żołądkowym powoduje choroby zwane nadkwaśnością i niedokwaśnością.
Kwas solny ma właściwości żrące, niszczy np. cukier, drewno, tkaniny, powoduje oparzenia skóry.
Zastosowanie kwasu solnego:
- w przemyśle farmaceutycznym
- w garbarstwie
- w przemyśle włókienniczym
- w przemyśle chemicznym
- do produkcji barwników
- w przemyśle cukierniczym
- do produkcji tworzyw sztucznych.
Kwas siarkowy (VI) H2SO4 (potocznie „kwas siarkowy”, bez podawania wartościowości siarki)
Jest cieczą oleistą, bezbarwną, bez zapachu, bardzo dobrze rozpuszcza się w wodzie, przy czym wydziela się duża ilość ciepła.
Należy zawsze wlewać kwas do wody.
Kwas siarkowy ma silne właściwości żrące. Jest niebezpieczny, bo niszczy tkaniny, zwęgla skórę, drewno.
Jest substancją higroskopijną, czyli pochłania parę wodną, nawet z powietrza. Pochłania również wodę zawartą w związkach chemicznych, dlatego np. drewno lub cukier w zetknięciu ze stężonym kwasem siarkowym ulega zwęgleniu.
Substancje te są zbudowane z węgla, tlenu i wodoru. Kwas odciąga pierwiastki tworzące wodę i po pewnym czasie z substancji tych pozostaje tylko węgiel.
Zastosowanie kwasu siarkowego.
- do produkcji barwników, np. atramentu,
- do akumulatorów,
- w przemyśle nawozów sztucznych,
- do produkcji leków mających w nazwie „sulfo...”
- do produkcji materiałów wybuchowych, np. trotylu, prochu, dynamitu,
- do produkcji środków piorących,
- do produkcji włókien sztucznych, np. sztucznego jedwabiu,
- w przemyśle petrochemicznym,
- do produkcji kosmetyków.
Ze względu na szerokie zastosowanie nazywa się go „krwią przemysłu chemicznego”.
Równanie reakcji otrzymywania kwasu siarkowego (VI)
Ilustracja modelowa:
Kwas azotowy (V) jest bezbarwną cieczą o ostrym zapachu. Jest cięższy od wody, jest cieczą lotną i łatwo przechodzi w stan pary, ma właściwości higroskopijne.
Stężony kwas azotowy (V) zwany jest potocznie „dymiącym kwasem azotowym”.
Wydzielające się pary kwasu pochłaniają parę wodną z powietrza tworząc mgłę.
Kwas azotowy (V) ma silne właściwości utleniające. Znaczy to, że może innym substancjom oddawać tlen, powodując ich utlenianie. Reakcja ta może przebiegać gwałtownie, z płomieniem, a nawet eksplozją.
Kwas azotowy (V) niszczy białko, przy czym powstają substancje o żółtym lub pomarańczowym zabarwieniu. Reakcję tę wykorzystuje się do wykrywania białek.
Zastosowanie:
- do produkcji azotowych nawozów sztucznych,
- do produkcji kosmetyków,
- w przemyśle spożywczym, np. do produkcji saletry potasowej, która jest środkiem konserwującym mięso,
- do produkcji środków chwastobójczych,
- do produkcji materiałów wybuchowych, np. prochu strzelniczego, trotylu, dynamitu,
- do produkcji tworzyw sztucznych, np. celuloidu, z którego robi się m.in. piłeczki pingpongowe,
- do produkcji barwników.
Równanie reakcji otrzymywania kwasu azotowego (V).
Ilustracja modelowa:
Kwas fosforowy (V) jest substancją stałą, krystaliczną, łatwo rozpuszczalną w wodzie. Nie jest kwasem żrącym.
Zastosowanie:
- do produkcji fosforowych nawozów sztucznych,
- do produkcji środków owadobójczych,
- do produkcji leków m.in. wzmacniających układ nerwowy,
- w przemyśle spożywczym jako środek smakowy i konserwujący przy produkcji np. coca-coli i innych napojów gazowanych,
- do produkcji środków piorących,
- jako składnik odrdzewiaczy.
Równanie reakcji otrzymywania kwasu fosforowego (V).
Ilustracja modelowa:
Kwas węglowy w życiu codziennym znany jest wyłącznie w roztworze rozcieńczonym, m.in. jako woda sodowa i gazowane wody mineralne. Kwas ten jest nietrwały i łatwo ulega rozkładowi na wodę i dwutlenek węgla.
Gazowany napój to kwas węglowy (dwutlenek węgla rozpuszczony w wodzie) z dodatkiem substancji smakowych. Gdy otwieramy butelkę, ucieka gaz - dwutlenek węgla, a w butelce zostaje woda i substancje smakowe.
Zastosowanie:
- do produkcji napojów gazowanych,
- w przemyśle chemicznym.
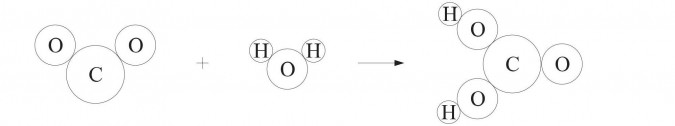
Równanie reakcji otrzymywania kwasu węglowego.
Ilustracja modelowa:
Pogłębiaj wiedzę w temacie: Kwasy
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.