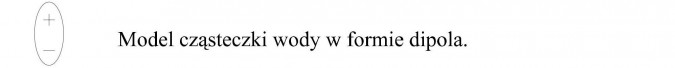zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
Cząsteczki wodorotlenków zbudowane są z atomów metalu i grup wodorotlenowych OH.
Liczba grup wodorotlenowych w cząsteczce wodorotlenku jest zawsze równa wartościowości metalu.
Wartościowość grupy wodorotlenowej jest zawsze równa jeden.
Me - symbol metalu
Mex(OH)x wzór ogólny wodorotlenków
Przykładowe wzory wodorotlenków: NaOH, KOH,
Mg(OH)2 czytamy Mg OH dwa razy wzięte
Fe(OH)3 czytamy Fe OH trzy razy wzięte
Nazwy wodorotlenków tworzymy dodając do słowa wodorotlenek nazwę metalu i jego wartościowość, np.:
Fe(OH)3 - wodorotlenek żelaza (III)
Fe(OH)2 - wodorotlenek żelaza (II)
KOH - wodorotlenek potasu
NaOH - wodorotlenek sodu
Mg(OH)2 - wodorotlenek magnezu
Jeżeli metal ma we wszystkich swoich związkach tę samą wartościowość, wówczas jej nie podajemy.
Wodorotlenki, które są rozpuszczalne w wodzie nazywamy zasadami, np. zasada sodowa, zasada wapniowa.
Wzory sumaryczne wodorotlenków zapisujemy tak, aby najpierw był symbol metalu, a za nim widoczna grupa wodorotlenowa.
Rysując wzór strukturalny wodorotlenku należy:
- znać wartościowość metalu (metal jest tylu wartościowy, ile jest grup OH),
- narysować od symbolu metalu tyle kresek, ile wynosi jego wartościowość,
- na końcu każdej kreski napisać symbol tlenu,
- od tlenu narysować po jednej kresce (bo tlen jest dwuwartościowy) i na końcu tej kreski napisać symbol wodoru.
Znane wodorotlenki to najczęściej związki metali 1 i 2 grupy układu okresowego. Można je otrzymać dwiema metodami:
(Inne metale i ich tlenki w większości przypadków nie reagują z wodą, a odpowiednie wodorotlenki otrzymuje się innymi specjalnymi metodami.)
W cząsteczce wody występuje wiązanie kowalencyjne spolaryzowane, wspólna para elektronowa jest przesunięta w kierunku atomu tlenu. Ładunki są nierównomiernie rozłożone i cząsteczka wody jest dipolem.
Pomiędzy atomem metalu i tlenu jest wiązanie spolaryzowane. Wspólna para elektronowa pochodząca od metalu i tlenu jest przesunięta w kierunku tlenu (dlatego, że ma więcej elektronów walencyjnych na ostatniej powłoce). Ładunek w cząsteczce wodorotlenku jest nierównomiernie rozłożony. W pobliżu metalu jest ładunek dodatni, zaś w pobliżu grupy — OH ładunek ujemny.
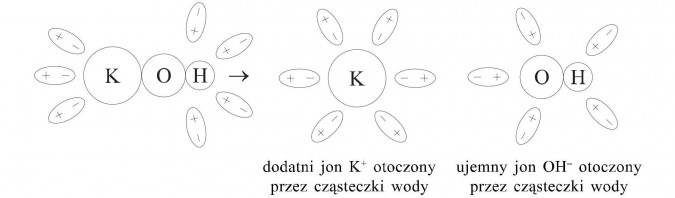
Pod wpływem oddziaływań dipoli wody i ładunków elektrycznych w cząsteczkach wodorotlenków zostaje rozerwane wiązanie pomiędzy atomem metalu i atomem tlenu.
Model rozpadu cząsteczki wodorotlenku potasu.
Interpretacja słowna: Jedna cząsteczka wodorotlenku potasu dysocjuje na jeden kation potasowy i jeden anion wodorotlenkowy.
Kationy metalu mają tyle ładunków dodatnich, ile powstaje anionów wodorotlenkowych (tyle samo wynosi wartościowość metalu, tyle jest grup— OH w wodorotlenku).
Interpretacja słowna: Jedna cząsteczka wodorotlenku wapnia dysocjuje na jeden kation wapnia i dwa aniony wodorotlenkowe.
Wodorotlenki sodu i potasu
NaOH wodorotlenek sodu
KOH wodorotlenek potasu
Są to substancje stałe, białe, silnie żrące.
Są higroskopijne, pochłaniają parę wodną z otoczenia. Granulki tych wodorotlenków stają się wilgotne, a następnie rozpływają się. Podczas rozpuszczania w wodzie wydzielają się duże ilości ciepła, dlatego jest to proces egzotermiczny.
Stopiony wodorotlenek sodu niszczy szkło i porcelanę, dlatego przechowuje się go w plastikowych butelkach.
Zastosowanie NaOH:
- do produkcji środków piorących, mydeł,
- w przemyśle włókienniczym jako środek bielący,
- przy produkcji papieru do wydzielania celulozy z drewna,
- do produkcji włókien sztucznych, np. jedwabiu sztucznego,
- do produkcji barwników do barwienia bawełny i lnu,
- w petrochemii,
- w przemyśle metalowym do odtłuszczania metali, usuwania rdzy ze stali.
Zastosowanie Ca(OH)2:
- w rolnictwie do wapnowania pól w celu odkwaszenia gleby,
- w budownictwie jako wapno jest składnikiem zaprawy murarskiej,
- w przemyśle chemicznym jako środek dezynfekujący,
- w przemyśle cukierniczym przy produkcji cukru,
- do zmiękczania wody.
Pogłębiaj wiedzę w temacie: Wodorotlenki
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.