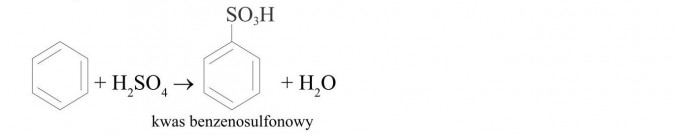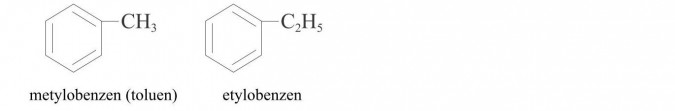zaprasza Cię do wspólnej nauki fiszek
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.
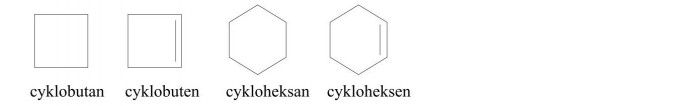
Węglowodory cykloalifatyczne - węglowodory o budowie pierścieniowej (do nazw odpowiedniego węglowodoru dodajemy przedrostek cyklo-) i właściwościach podobnych do węglowodorów alifatycznych.
Wzory węglowodorów cykloalifatycznych przedstawiamy w postaci figur geometrycznych, np.
Dla cykloalkanów charakterystyczną jest reakcja substytucji (podstawiania) halogenów, np.:
Dla cykloalkenów i cykloalkinów reakcją charakterystyczną jest reakcja addycji, np.:
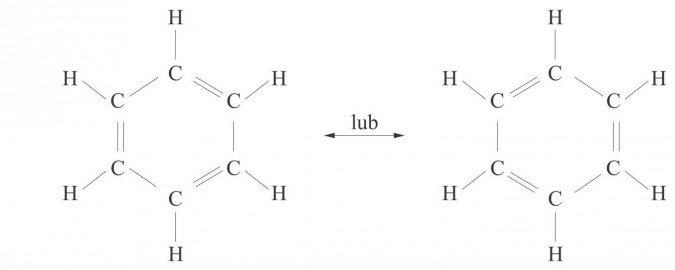
Węglowodory aromatyczne (areny) - związki o budowie cyklicznej, zawierające wiązanie zdelokalizowane pomiędzy wszystkimi atomami węgla tworzącymi pierścień. Głównym przedstawicielem tej grupy węglowodorów jest benzen C6H6, którego cząsteczkę tworzy 6 atomów węgla, każdy związany z 1 atomem wodoru, leżących w narożach sześciokąta foremnego (cząsteczka płaska):
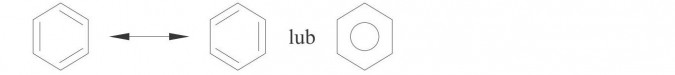
Wg teorii Kekulego atomy węgla w benzenie wiążą się ze sobą na przemian wiązaniami pojedynczymi i podwójnymi. Wiązania te przemieszczają się w cząsteczce, dlatego pełny wzór strukturalny benzenu możemy narysować w postaci dwóch struktur, które można przedstawić prościej:
a) benzen otrzymuje się:
- ze smoły węglowej
- z acetylenu
b) właściwości fizyczne benzenu - bezbarwna, lotna ciecz o charakterystycznym zapachu, nie rozpuszcza się w wodzie. Dobry rozpuszczalnik substancji organicznych i nieorganicznych. Ma właściwości rakotwórcze.
c) właściwości chemiczne benzenu:
- spala się kopcącym płomieniem, co świadczy o dużej zawartości węgla w cząsteczce.
Spalanie całkowite:
Spalanie częściowe:
lub
- reakcje addycji
wodoru:
halogenu:
- reakcje podstawiania (substytucji)
halogenu:
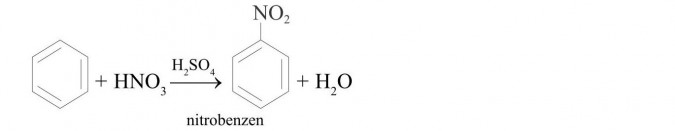
reakcja nitrowania:
reakcja sulfonowania:
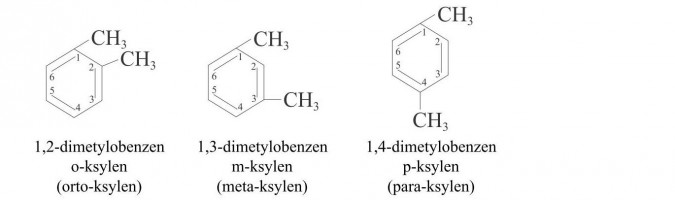
d) homologi benzenu - związki organiczne, które zawierają w cząsteczkach pierścień benzenowy i jeden lub kilka nasyconych łańcuchów węglowodorowych, np.:
Związki te są izomerami, różniącymi się położeniem grup metylowych. Zamiast lokantów, podających położenie grup węglowodorowych stosuje się system przedrostków: orto- (lokanty 1 i 2), meta- (lokanty 1 i 3) oraz para- (lokanty 1 i 4). W nazewnictwie węglowodorów aromatycznych nie stosuje się reguł obowiązujących dla innych węglowodorów, np. nazwy pochodnych benzenu tworzy się od ich nazw zwyczajowych.
Pogłębiaj wiedzę w temacie: Węglowodory pierścieniowe (cykliczne)
Teksty dostarczyło Wydawnictwo GREG. © Copyright by Wydawnictwo GREG
Autorzy opracowań: B. Wojnar, B. Włodarczyk, A Sabak, D. Stopka, A Szostak, D. Pietrzyk, A. Popławska, E. Seweryn, M. Zagnińska, J. Paciorek, E. Lis, M. D. Wyrwińska, A Jaszczuk, A Barszcz, A. Żmuda, K. Stypinska, A Radek, J. Fuerst, C. Hadam, I. Kubowia-Bień, M. Dubiel, J. Pabian, M. Lewcun, B. Matoga, A. Nawrot, S. Jaszczuk, A Krzyżek, J. Zastawny, K. Surówka, E. Nowak, P. Czerwiński, G. Matachowska, B. Więsek, Z. Daszczyńska, R. Całka
Zgodnie z regulaminem serwisu www.opracowania.pl, rozpowszechnianie niniejszego materiału w wersji oryginalnej albo w postaci opracowania, utrwalanie lub kopiowanie materiału w celu rozpowszechnienia w szczególności zamieszczanie na innym serwerze, przekazywanie drogą elektroniczną i wykorzystywanie materiału w inny sposób niż dla celów własnej edukacji bez zgody autora jest niedozwolone.